Siaft Koligatif Larutan merupakan sifat yang hanya bergantung kepada jumlah kuantitas partikel zat pelarut dalam larutan. Ia tidak bergantung pada jenis atau identitas zat yang terlarut. Tidak perduli apakah ia dalam bentuk atom, ion ataupun juga molekul. Sifat Koligatif adalah sifat yang hanya memandang kuantitas dan bukan kualitas. Sifat larutan yang seperti rasa, warna dan kekantalan adlah sifat yang bergantung kepada jenis zat tertentu. Contohnya larutan CH3COOH (asam cuka) akan terasa asam.
A. Sifat-Sifat Koligatif Larutan
1. Penurunan Tekanan Uap
Jika zat tersebut terlarut memiliki sifat non-volatil (tak mudah menguap, tekanan uap tidak bisa terkukur). Tekanan dari larutan akan selalu lebih rendah daripada tekanan uap pelarut murni yang volatil. Idealnya tekanan uap dari pelarut volatile diatas larutan yang mengandung zat terlarut yang non-volatil. Ini berbanding terbalik dengan konsentrasi pelarut dalam larutan. Dalam hubungannya sifat koligatif larutan dinyatakan secara kuantitatif. Hal ini tercantum di dalam hukum Raoult yaitu : tekanan uap pelarut diatas larutan, P Pelarut ini sama dengan hasil kali fraksi mol dari pelarut, X pelarut dengan menggunakan tekanan uap dari pelarut murni, P’ palrut.
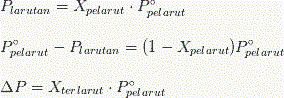
2. Kenaikan Titik Didih
Titik didih dari larutan merupakan temperature ketika tekanan uapnya sama dengan tekanan external. Oleh karenanya terjadi penurunan tekanan uap terhadap larutan oleh keberadaan zat terlarut non-volatil. Dibutuhkan kenaikan temperature untuk menaikan tekanan uap larutan hingga sama dengan tekanan external. Keberadaan zat terlarut dalam pelarut mengakibatkan terjadinya kenaikan titik didih : titik didih larutan, Tb, lebih tinggi dari titik didih pelarut yang murni, Tb’.
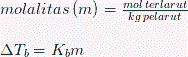
Kb adalah konstanta kenaikan titik didih molal (dalam satuan C/m) dan m molalitas larutan.
3. Penurunan Titik Beku
Untuk larutan dengan pelarut volatile dan juga zat terlarut non-volatil, hanya partikel pelarut yang bisa menguap dari larutan hingga meninggalkan pertikel zat terlarutnya. Hal yang sama terjadi dengan banyak kasus yang mana hanya partikel-partikel pelarut saja yang memadat atau membeku. Meninggalkan partikel-partikel zat terlarut yang akan membentuk larutan dengan konsentrasi yang lebih pekat. Titik beku dalam sebuah larutan adalah temperature dimana tekanan uap dari larutan sama dengan tekanan uap pari pelarut yang murni. Dalam temperature ini, dua fase – pelarut padat dan larutan cair – berada di dalam keseimbangan.
Oleh sebab itu terjadi penurunan tekanan uap dan juga larutan dari tekanan uap terhadap larutan. Larutan membeku di temperature yang relative lebih rendah dibandingkan dengan titik beku pelarut murni. Bisa dikatakan bahwa jumlah partikel – partikel pelarut yang keluar yang masuk dalam padatan kemudian membeku per satuan waktu yang menjadi sama pada temperature yang juga lebih rendah. Sifat koligatif larutan ini berupa penurunan titik beku yang berbanding lurus terhadap konsentrasi larutan
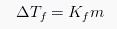
Dimana Kf merupakan konstanta penurunan pada titik beku molal (dalam satuan ‘C/m) dan m merupakan molalitas larutan
4. Tekanan Osmosis
Dua larutan dengan konsentrasi berbeda dipisahkan oleh suatu membrane semipermeabel – membrane yang hanya bisa dilewati oleh partikel pelarut. Tetapi tidak bisa diawali oleh partikel zat terlarut – maka terjadilah fenomena osmosis itu. Osmosis merupakan peristiwa perpindahan yang selektif dari pertikel-pertikel pelarut. Dengan melalui membrane semipermeable dari larutan dengan konsentrasi zat terlarut yang juga lebih rendah ke larutan yang konsentrasi zat terlarutnya lebih tinggi.
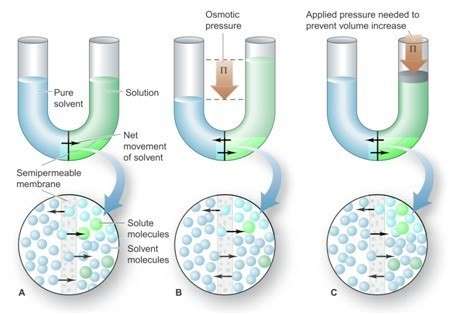
Tekanan osmosis dapat didefinisikan sebagai tekanan yang diberikan sebagai penahan perpindahan netto partikel pelarut dari larutan. Dengan konsentrasi pelarut yang tinggi menuju larutan dengan konsentrasi pelarut yang rendah. Jika tekanan dari eksternal sama besar dengan tekanan dari osmosis akan diberikan pada sisi larutan. Maka ketinggian pelarut dan juga larutan akan kembali seperti semula. Tekanan osmosis berbanding lurus terhadap jumlah partikel zat yang terlarut dalam volume larutan tertentu yang merupakan molaritas.
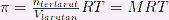
Dimana R merupakan konstanta dari gas ideal (0,0821 L.atm/mol.K) dan T merupakan temperature ( dalam satuan K )
B. Sifat Koligatif Larutan Elektrolit Kuat
Pendekatan sifat koligatif pada larutan elektrolit kuat terdapat sedikit perbedaan dengan sifat koligatif larutan nonelektrolit. Ini disebabkan karena sifat elektrolit yang bisa terdisosiasi menjadi ion-ion di dalam larutan. Contohnya dalam satu unit senyawa CaCl2 dapat terdisosiasi menjadi 3 partikel ketika dilarutkan yaitu : 1 ion Ca2+ dan 2 ion Cl-. Perlu diperhitungkan factor van’t hoff (i) terhadap perhitungan larutan elektrolit.
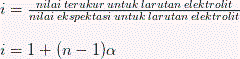
Dimana n = jumlah ion yang terdisosiasi dari 1 unit formula senyawa
Pemahaman tentang proses pelarutan ini menjadi hal yang penting untuk memahami siat koligatif larutan. Kelarutan pada suatu zat dalam pelarutan tertentu dapat dipengaruhi oleh factor dari temperature. Ukuran partikel, aksi dari luar dan juga sifat-sifat zat yang terlarut. Factor-faktor ini berkaitan erat dengan sifat koligatif larutan